CircRNA:ncRNAs界的新明星分子
研究背景:
2012年以前,经典教科书和主流观点里,RNA还是线性的,主要有这3类RNA:mRNA、tRNA和rRNA,但随着时间的推进,研究的深入,越来越多的RNA被发现,除了本世纪初备受关注的miRNAs,snRNA,siRNA,LncRNA,还有近年来研究最火热的环状RNA(circRNA),circRNA的研究如火如荼,国内研究也紧抓热点,从国家自然科学基金的倾向性可见一斑,因此circRNA成为ncRNAs界的“新宠儿”。
下面小编带大家了解下circRNA的研究思路与方法。
环状RNA (circRNA)是一类新的具有调控功能的非编码RNA,具有闭合环状结构,大量存在于真核转录组中。大部分的环状RNA是由外显子序列构成,在不同的物种中具有保守性,同时存在组织及不同发育阶段的表达特异性。由于环状RNA对核酸酶不敏感,所以比线性RNA更为稳定,这使得环状RNA在作为新型临床诊断标记物的开发应用上具有明显优势。
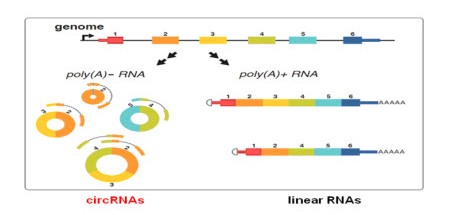
图1. circRNA在哺乳动物细胞中的形成
circRNA的研究思路
一、筛选circRNAs
常用方法:高通量芯片筛选,RNA-seq等。
二、验证与鉴定circRNA+表达分析
常用方法:Q-PCR,FISH,Northern等。
circRNA定量验证手段与常规PCR手段不同,常规手段是围绕目的片段的上下游分别设计PCR引物,称之为convergent primer,需扩增的片段位于上下游引物之间(如图2)。而对于circRNA,尤其外显子环化circRNA,除backsplice junction位点处不同于linear RNA之外,body区与linearRNA是一致的。因此,验证时需要特异性针对backsplice junction位点处设计primer,称之为divergent primer(如图2),而且设计的PCR product的长度越短越好,可以增强backsplice junction位点处扩增效率。
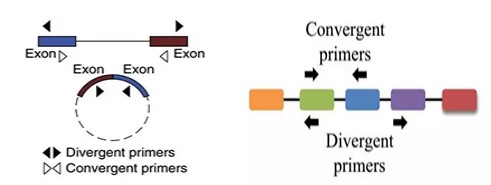
图2. convergent primer vs divergent primer
circRNA表达的组织特异性验证:用原位杂交技术(Situ Hybridization)进行验证。设计杂交探针时要跨backsplice junction位点,而后可很清楚的看到circRNA在哪些组织中表达很高,作为组织特性判断的依据。细胞定位是决定调控机制研究方向的关键。
三.circRNA功能分析
常用方法:
正向验证——circRNA过表达
circRNA过表达思想主要源于circRNA生物形成机制,已有多篇文章报道circRNA成环机制,目前比较公认的成环机制为circRNA侧翼序列的碱基互补配对,称之为Alu结构(如图3)。
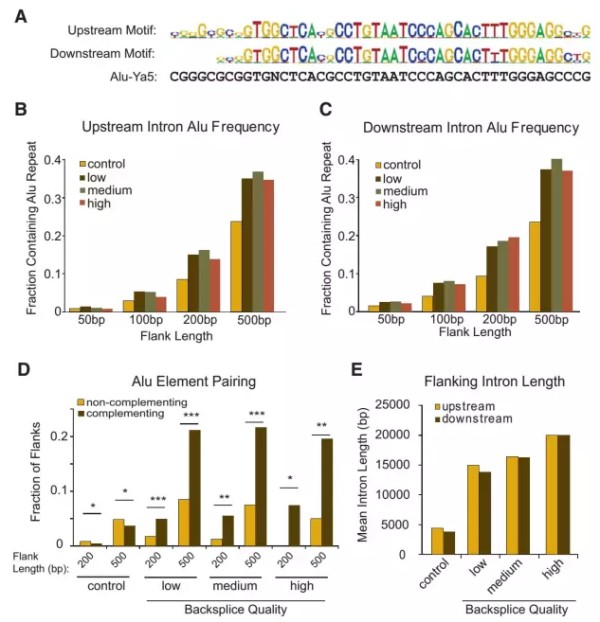
图3. circRNA侧翼结构特征
过表达策略:
扩增目标区域包含circRNA侧翼Alu序列或内部碱基互补序列,侧翼上下游1kb处过表达效率更佳;
目标区域扩增基于基因组DNA为模版。
反向验证——circRNA敲除
circRNA敲除思路主要针对circRNA backsplice junction处序列信息设计siRNA,对于内含子环化circRNA,也可针对内含子区域设计相应siRNA进行干扰。Divergent primer验证circRNA敲除倍数。
敲除策略:
外显子环化circRNA,针对backsplice junction位点前后序列设计siRNA,如图所示;
内含子环化circRNA,除针对backsplice junction位点前后序列设计siRNA序列以外,也可针对内含子区域序列设计siRNA。
每个siRNA设计对应的对照,backsplice junction位点一端互补配对,另一端错配(如图4)。
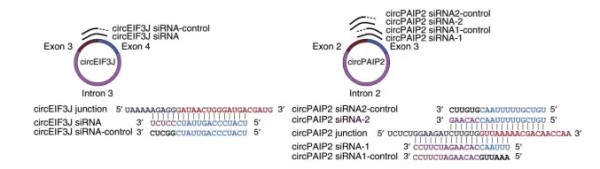
图4. 基于siRNA敲除策略
四、circRNA机制研究
目前针对circRNA的功能机制研究不多,潜在的调控基因表达和蛋白合成方式有:
circRNA可以作为“sponge”海绵吸miRNA,调节靶基因;
circRNA能与蛋白质/RNA结合,募集蛋白质复合体的组分或调控基因的表达;
circRNA通过碱基互补配对直接调控其他RNA水平。
一般来说,ceRNA调控机制是circRNA作用机制研究的首要选择,因而很多文章优先从ceRNA的角度去解释其作用机理。而circRNA作为miRNA的“sponge”有两个基本前提:①circRNA和mRNA有共同的miRNA结合位点;②circRNA影响其竞争结合对象mRNA的表达。用RNA-FISH确认circRNA在细胞中的定位。细胞定位是决定调控机制研究方向的关键。转录后调控尤其是ceRNA调控,一般认为在细胞质中进行,如果该circRNA主要定位于细胞质,那么是有可能成为ceRNA分子的。寻找靶定circRNA的miRNA及miRNA靶定的mRNA的方式:①利用生物信息学对其进行预测,即通过miRcode/starBase筛选circRNA潜在的miRNA结合位点(MRE),同时通过miRTarBase预测miRNA的靶基因。而后用通过荧光素酶报告系统及免疫共沉淀(RIP)进行验证circRNA和mRNA之间的表达呈正相关性;②也可直接通过circRNA+mRNA组合芯片高通量筛选,分析差异表达circRNA和mRNA之间的表达相关性分析,寻找与circRNA关系密切的mRNAs
最后,验证circRNA对miRNA及其下游靶基因的表达影响。这部分可通过过表达和沉默circRNA中检测mRNA的变化,过表达和沉默mRNA来检测circRNA的变化以及circRNA和mRNA表达相关性分析加以验证。
circRNA的应用
circRNA没有“尾巴”
常规存在于线性RNA分子中的3’和5’端在环状RNA中被连接形成了闭合环状结构(图1)。而经典的RNA检测方法只能分离具有PolyA“尾巴”结构的RNA分子,所以环状RNA在以往的研究中通常被忽略。
circRNA不翻译
虽然很多circRNA是由蛋白编码基因产生,但是还没有结果显示circRNA在细胞中编码蛋白。环状RNA也因此被定义为一类新型非编码RNA。
circRNA的细胞定位和稳定性
大部分环状RNA在细胞浆中富集,有时其丰度甚至比相应的线性mRNA高10余倍,这可能是由于环状RNA比线性RNA更稳定造成的。核酸酶往往通过识别线性RNA分子末端发挥作用,环状RNA是一个闭合结构,因此对核酸酶具有高耐受性。
文献案例
2021年3月24日,浙江大学医学院附属邵逸夫医院蔡秀军教授团队与郭行教授团队合作,在Science Advances发表题为“A tumor-suppressive circular RNA mediates uncanonical integrin degradation by the proteasome in liver cancer”的研究长文,报道一种新型环状RNA通过直接介导整合素β1经26S蛋白酶体降解进而抑制肝癌转移的全新机制。
本研究鉴定出一种在肝癌组织中显著低表达的新型环状RNA-circPABPC1,且预后分析显示circPABPC1水平与肝癌患者的生存率呈正相关。circPABPC1可通过干扰肝癌细胞的黏附能力,显著抑制肝癌进展,特别是抑制早期的肝内转移。研究人员鉴定出整合素β1(ITGβ1)是circPABPC1的下游主要效应蛋白。进一步的研究结果表明,circPABPC1可以作为蛋白间的支架(protein scaffold)直接促进ITGβ1经蛋白酶体降解,这与经典理论认为膜蛋白主要通过溶酶体代谢循环不同,是一种全新的膜蛋白降解模式。
随着近年来在RNA递送技术和RNA体外合成修饰技术的进步,越来越多研究提示具有高稳定性和易递送性特点的circRNA有望成为新型药物。本文研究结果显示,circPABPC1发挥功能的形式与蛋白降解靶向嵌合体(PROTACs)技术具有共通性。通过适当的突变改造,circRNA具备靶向降解其他膜蛋白的潜能。
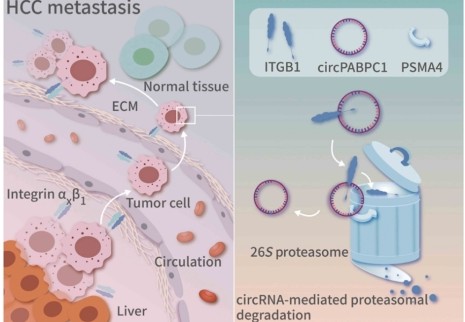
图5. 机制阐述
原文链接:https://advances.sciencemag.org/content/7/13/eabe5043
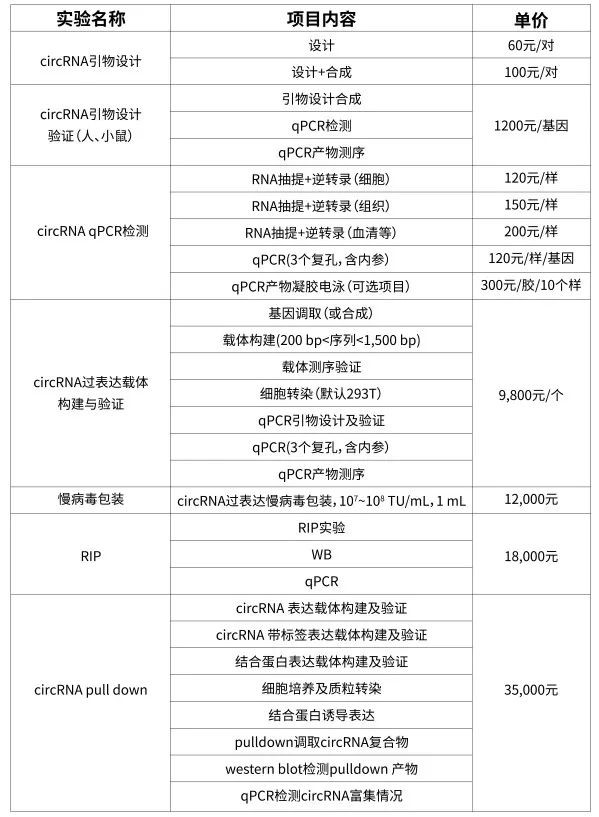
擎科可提供:
回复小编或联系[email protected]即刻开聊,下单可直接联系当地销售经理。
网址:CircRNA:ncRNAs界的新明星分子 http://c.mxgxt.com/news/view/278306
相关内容
改变世界的明星分子闲说影视歌星在曲艺界的辈分
探索偶像的最新下海之路,揭秘明星跨界的新动态,探索偶像跨界新动态,明星下海之路揭秘
明星无边界互动:激情养娃的新方式
章子怡综艺质疑跨界:明星界限模糊,跨界圈钱引争议
SHINY BOYS王嘉豪、丁子轩 时尚界的新星
古典占星中的三分主星、界与面系统整理
明星跨界VC:中国合伙人的新戏码
《奇异新世界》明星讨论斯波克的三角恋
时尚界的新明星:贝克汉姆夫妇

